天选兰花的生存智慧:成功需要努力配点运气
天选兰花的生存智慧:成功需要努力配点运气
作者:中国科学院植物研究所李彤
三枚萼片、三枚花瓣、一个合蕊柱,这样独特的外貌让我们可以很容易辨认出兰科植物。兰科植物种类丰富,当前确认的约有815属22000-27000余种。它们的花瓣千姿百态,有袋状的兜兰(Paphiopedilum spp.)、瓣状的文心兰(Oncidium flexuosum)、分叶状的鹤顶兰(Phaius tancarvilleae)、丝状的章鱼兰(Prosthechea cochleata)等超过数十种类型,颜色也极为丰富,几乎涵盖了可见光谱中的所有颜色,如红色系火焰兰(Renanthera coccinea)、紫色系紫纹兜兰(Paphiopedilum purpuratum)、白色系夜夫人白拉索兰(Brassavola nodosa)等等;身材魁梧如身高最高可达7米的皇后兰(Grammatophyllum speciosum),娇小柔弱如花序仅有1-2cm的小沼兰(Oberonioides microtatantha)。兰科植物的每个形态、每种特点都不是随便长长,而是为了生存、繁衍、适应环境,千锤万凿雕刻出来的自然艺术品。
 图片说明:1.文心兰2.鹤顶兰3.章鱼兰4.火焰兰
图片说明:1.文心兰2.鹤顶兰3.章鱼兰4.火焰兰
5.紫纹兜兰6.夜夫人白拉索兰7.皇后兰8.小沼兰
(图片来源:李光敏、刘冰、吴棣飞、华国军、
金宁、叶喜阳;NParks Flora & Fauna Web;制图:李彤)
一、努力+运气=增加被自然选择的概率
约6500万年前,一颗直径10公里的小行星以每秒20公里的速度撞击地球,引发了海啸、全球性火山爆发、食物链断裂和持续数年的“核冬天”,称霸地球1.6亿年的恐龙就此灭绝,在这场“末日筛选”中,仅有约25%的物种幸运地被自然选择存活下来,成为“新生代地球”的新主人,其中就有兰科植物的祖先。
成功很大程度上取决于是否被环境选择,身上的技能越多,被选择的概率就越大。碰巧在白垩纪末大灭绝前经历了一次全基因组复制(WGD)事件的兰科植物祖先,将自己的遗传密码完整复制了一份,并在较短的时间内分化出即可陆生,又可附生,还可腐生的五个亚科—拟兰亚科(2属17种)、香荚兰亚科(15属种)、杓兰亚科(5属种)、树兰亚科(500多属24000种)和兰亚科(208属3630种)(数据截至2019年),这些植物能够在不同的气温、温度与光照条件下存活,如此强大的环境适应性不仅让兰科植物从灭绝边缘幸存,还让它们迅速占据了因大灭绝造成的空缺生态位,逆袭成为可以在地球上大部分栖息地定居的居民,发展成当今被子植物中种类最丰富且形态高度特化的类群之一。
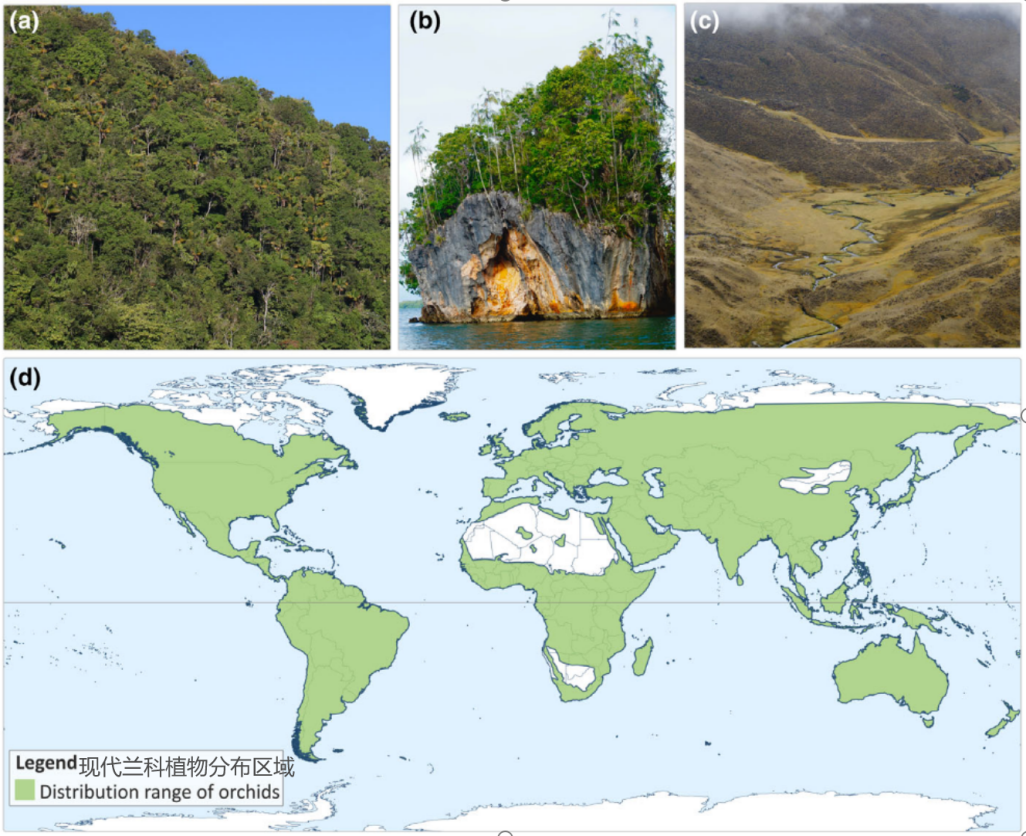
兰科植物的现代分布区域
(图片来源:Pérez-Escobar et al.2024)

图片说明:1.热带雨林多花兰2.温带森林广布小红门兰3.温带草原湿润地带的紫花地丁
4.湿地生境中竹叶兰5.荒漠边缘地区的百岁兰6.人工栽培的蝴蝶兰
(图片来源:朱鑫鑫、朱仁斌、金宁、魏泽、李光敏;制图:李彤)
二、摒弃短板,躺平但不摆烂
生活在阴湿环境的腐生兰天麻(Gastrodia elata)是反内卷的榜样。在郁闭且光照微弱的的森林中,努力争夺生存资源以获取更多营养物质是生存的关键(如红杉拼命长高争夺阳光),因此许多植物选择在光照竞争中拼命内卷“光合技术”。生活在卷王圈子的天麻却生的身材矮小,没有根也没有叶,全身上下最宝贵的就是它的块状根,这样的天麻如果要靠“光合技术”提高竞争力似乎很难存活,于是天麻没有拘泥于传统思路,它们分析了环境和自身条件,不跟风卷“光合技术”,而是选择“躺平”,逐步“卸载”掉光合相关基因,将制造养分的任务外包给真菌。这种截然不同的生存路径,节省了大量维护叶绿体的能量成本,节省来的能量成本可以帮助天麻专注于发展分解真菌细胞壁,比如3倍扩张分解真菌细胞壁的几丁质酶基因、通过海藻糖水解酶高效分解真菌菌丝中的养分来榨取营养,使其能在黑暗的森林底层稳稳地“躺赢”,过着衣来伸手饭来张口的神仙生活。
 1.天麻全株2.天麻花序3.天麻块状根
1.天麻全株2.天麻花序3.天麻块状根
(图片来源:安红旗、魏泽、赵宏;制作:李彤)
三、降本增效,薄利多销
兰科植物不仅是“反内卷王”,还深谙“降本增效”之道。胚乳是种子中储存营养物质的重要营养包,但也同时会一定程度上增加种子的体积和重量。为了扩大种子的扩散范围,兰科植物再一次选择“断舍离”,卸载掉产生胚乳的typeI Mβ MADS-box基因,成功把自己的种子进化成轻量级选手。没有胚乳的兰科植物单个蒴果内通常有上万粒种子,这些种子仅0.3-14微克,形似灰尘,可借助风力传播数百公里,甚至附着在鸟类羽毛上远行。这种“轻量化设计”大幅提升了种群的扩散能力,让它们能够到达树皮缝隙、岩石表面等特殊的生态位。
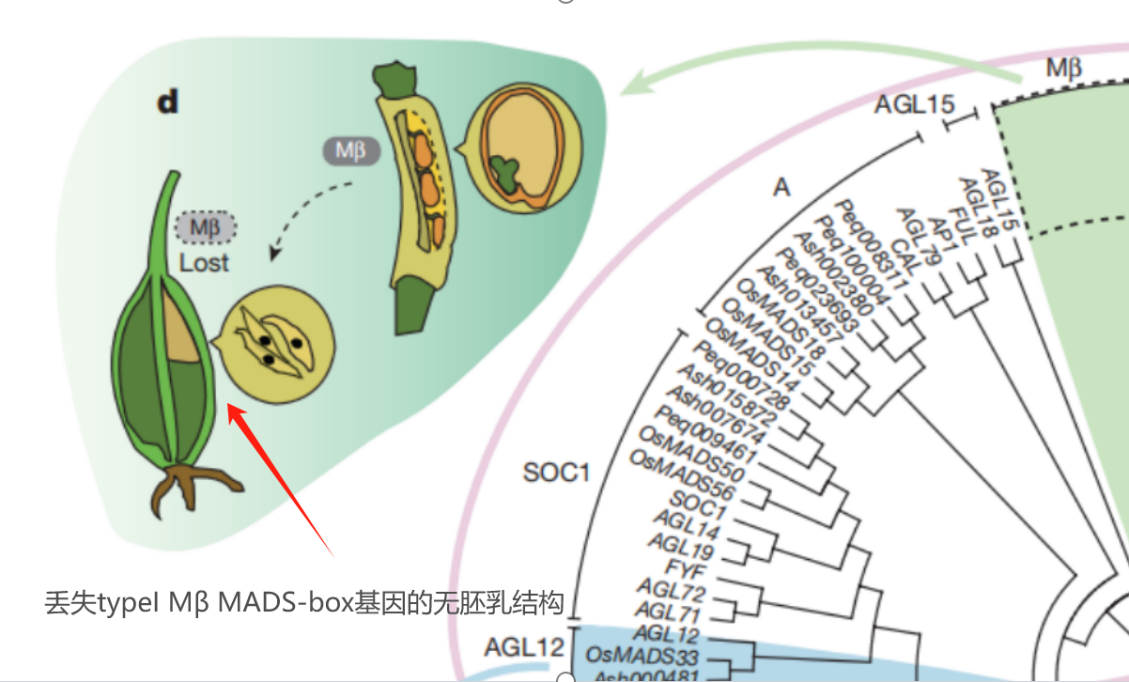
(图片来源:ZHANG·G·Q et al.,2017;制图:李彤)
四、主动适应环境,化被动为主动
植物的生长发育需要充足的营养物质,在遇到营养条件不足的情况时,兰科植物没有抱怨环境,而是主动改变,适应环境。
附生性兰科植物在根部进化出了特殊的适应性构造,比如海绵表皮和根膜,这些组织可以帮助它们更好附生于其他植物(通常是树木)、岩石和固体物上,并从雨水和空气中收集水分和养分。比如野生蝴蝶兰(Phalaenopsis aphrodite)大多生长在树枝上,它们的部分根系会紧贴在一些灌木或缠绕在树干上,但不会吸取树木的养分,只是依靠树木吸取空气中的养分水分,并不会对树木造成任何伤害。这种附生特性帮助它们占领了许多其他植物企及不到生境领地,而且这些生境之间存在很大差异,容易隔断兰科植物物种的基因交流(即生境隔离),有助于促进兰科植物内部新物种的产生。


蝴蝶兰
(图片来源:李光敏)
五、创新进取新领域,填补“传统技术”空白
近亲繁殖会影响人口质量,植物也是。植物们为了防止后代同质化,在胚乳中进化出了杂交屏障的功能,可阻止新形成的多倍体与其非多倍体祖细胞进行杂交,进而促进被子植物的进化。
缺少胚乳的兰科植物也有自己的办法,它们大胆创新,将花粉粒粘合成块,形成花粉块,花粉块不会像花粉那样漫无目的、广撒网式的散播,而是可以附着在授粉昆虫身上在花朵间进行一对一的传粉。花粉块的形成,是兰科进化史上的一项关键创新,不仅促成了生殖隔离,有助于新物种的形成,还在该种群的辐射分布方面发挥重要作用。
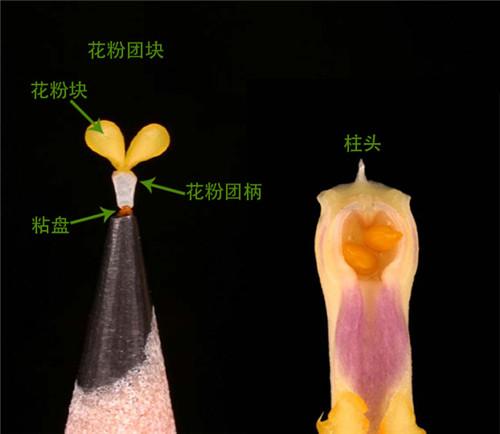
(图片来源:引自Mark Whitten)
六、聚焦优势,灵活迭代新策略
独特的花粉团结构虽很好解决了后代同质化的问题,但也局限了兰科植物授粉的渠道,使得兰科植物只能依靠虫媒或者自花授粉,难以利用风媒传粉。为了使后代更优秀,兰科植物只有很少一部分会选择自花授粉,如大根槽舌兰(Holcoglossum amesianum),所以兰科植物对于昆虫的需求随之增加。如何吸引昆虫?独特的唇瓣结构发挥了优势。

图片:大根槽舌兰自花授粉过程
a. 花粉从花药运输到柱头过程中花部结构的排列及其运动(虚线)(在 c-g 中描述);b. 授粉开始前开放的花朵;c. 花药帽打开并从蕊柱上脱落;d. 花丝顶端携带两个花粉块上升;e. 向下弯曲穿过蕊喙;f. 花丝接着向上朝柱头弯曲;g.将花粉块插⼊柱头腔
(图片来源:蓬斛阆苑、Liu et al.,2006)
唇瓣(修饰的花瓣)是兰科植物其最显著的特征之一,可以吸引昆虫并为其提供采蜜时的“着陆平台”。发现自己唇瓣优势的兰科植物,不断放大自己的优势,在唇瓣的形态、颜色、气味等方向发力创新。部分兰科植物(约有1/3)通过模拟、伪装等手段,诱骗传粉者为它们传粉,比如足茎毛兰(Eria coronaria)利用唇瓣上的黄色斑块模拟成美味的食物,吸引馋嘴的中华蜜蜂的光临。

(图片来源:昆明植物研究所官网)
南非的无报酬兰花Disa pulchra与鸢尾科植物Watsonia lepida分布区域重叠,于是它们模仿这种鸢尾科植物的颜色和花型,吸引它们的“客户虫虫”前来觅食,昆虫在两者之间难以分辨,最终为兰花完成传粉。

南非的无报酬兰花Disa pulchra和鸢尾科植物Watsonia lepida对比
(图片来源:Schlüter PM et al.,2008)
土蜂兰(Ophrys speculum)唇瓣呈现金属光泽的蓝色斑块,模拟雌性胡蜂腹部,同时还释放出与雌性昆虫相似的性激素信号,就像“蓝牙信号一样”,等待发情的雄性胡蜂前来配对传粉。

土蜂兰
(图片来源:李佳侬)

“受骗的”胡蜂
(图片来源:http://www.pharmanatur.com)
长瓣兜兰利用花瓣上的黑色突出物模拟黑带食蚜蝇的幼虫食物,让黑带食蚜蝇母亲误以为这是食物丰富的哺育场所,兴高采烈地前来产卵,在产卵过程中为长瓣兜兰完成授粉。

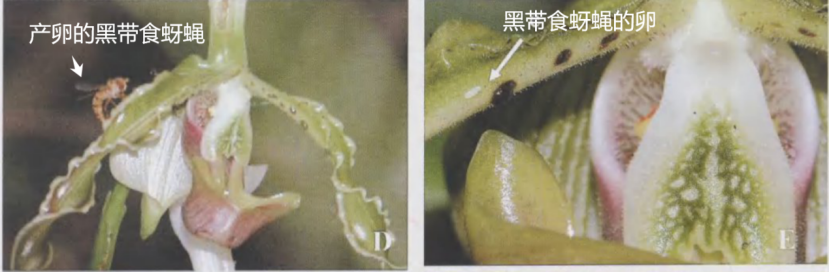
1.长瓣兜兰上的黑色突出物2.产卵的黑带食蚜蝇3.黑带食蚜蝇的卵
(图片来源:昆明植物研究所官网;史军等,2007)
当植物学家一层层剥开兰科植物的进化奥秘时,也同时向我们展现并传递了兰科植物坚强的生存智慧,让我们在欣赏它们美丽外表的同时,也感叹生命的奇迹。当下,我们正面临着文化、科技进步带来的多重冲击,如何才能更好度过这个充满不确定性的时代?或许可以用谦逊的态度,学习参考自然的智慧,通过“分析环境与自身条件—规避短板不盲目内卷—聚焦优势大胆创新—长期稳定发展”这样的生存SOP去思考新的生存路径,探索出适合自己的核心竞争力和立足之本。
参考文献:
蔡文杰.兰科植物的起源和进化[J].福建农林大学学报:自然科学版, 2019, 48(6):7.DOI:CNKI:SUN:FJND.0.2019-06-002.
史军,程瑾,罗敦,上官法智,罗毅波.利用传粉综合征预测:长瓣兜兰模拟繁殖地欺骗雌性食蚜蝇传粉[J].植物分类学报,2007,45(4):551-560
CAI J, LIU X, VANNEST'E,K, et al. The genome sequence of the orchid Phalaenopsis equestris[Jl. Nat Genet, 2015,47:65-72
CHRISTENHUSZ·M J,BYNG·w..The·number·of.known'pS'species in'the world and its annual.increaseLant[J].·Phytotaxa,·2016,261(3):201-217.2.
Department of Plant Biology, Swedish University of Agricultural Sciences and Linnean Center for Plant Biology, Uppsala 75007, Sweden
Givnish, T. J. et al. Orchid phylogenomics and multiple drivers of their extraordinary diversification. Proc. R. Soc. B 282, 1553 (2015)
Givnish, T. J. et al. Orchid historical biogeography, diversification, Antarctica and the paradox of orchid dispersal. J. Biogeogr. 43, 1905–1916 (2016)
Jiao, Y., Peluso, P., Shi, J. et al. Improved maize reference genome with single-molecule technologies. Nature 546, 524–527 (2017). https://doi.org/10.1038/nature22971
Pérez-Escobar,et al., Forest, F., Nargar, K., Renner, S.S., Baker, W.J. and Antonelli, A. (2024), The origin and speciation of orchids. New Phytol, 242: 700-716.
Roberts, D. L. & Dixon, K. W. Orchids. Curr. Biol. 18, R325–R329 (2008)
Schlüter PM, Schiestl FP. Molecular mechanisms of floral mimicry in orchids. Trends Plant Sci. 2008 May;13(5):228-35. doi: 10.1016/j.tplants.2008.02.008. Epub 2008 Apr 16. PMID: 18424223.
WU Z Y, RAVEN P H, HONG D Y. Flora of China M. Beijing: Science Press, 2007:25
YEUNG E C.A perspective on orchid seed and protocorm development[J].Botanical studies,2017,58:1-14.
ZHANG·G·Q,·LIU.K.W,·LI·Z,·et·a1.2.The·Apostasia·genome and.the.evolutionof.orchidsJ549:379-383.Nature.·2017
Zuntini, A.R., Carruthers, T., Maurin, O. et al. Phylogenomics and the rise of the angiosperms. Nature 629, 843–850 (2024). https://doi.org/10.1038/s41586-024-07324-0
图文简介
